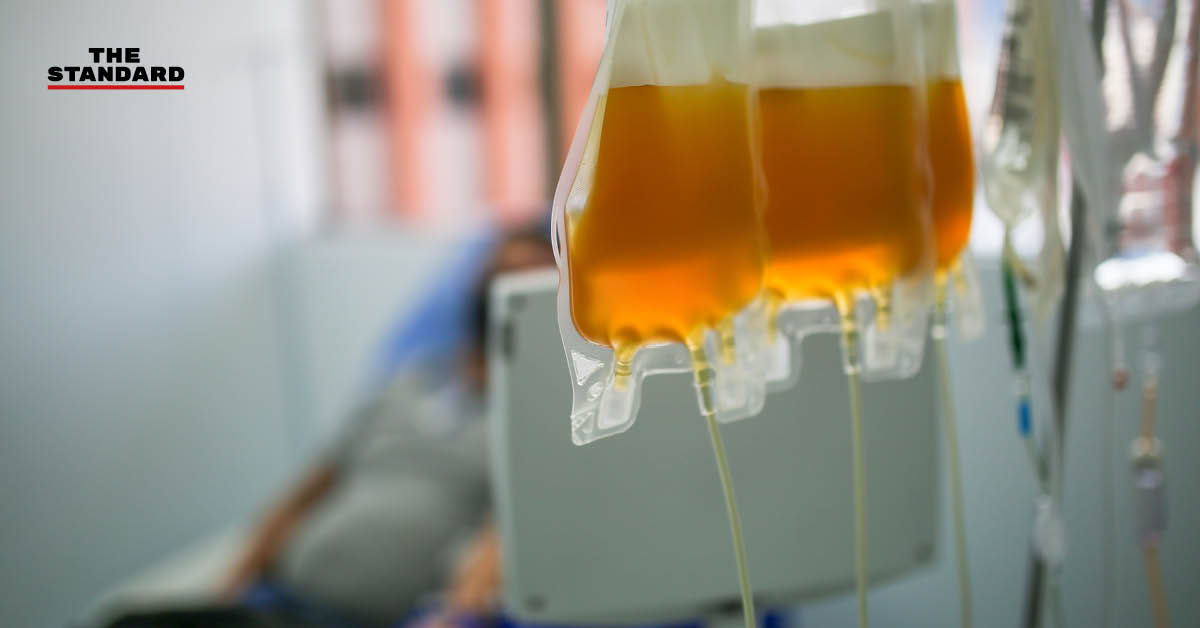
สำนักงานคณะกรรมการอาหารและยาของสหรัฐ หรือ FDA ออกประกาศอนุญาตใช้งานกรณีฉุกเฉิน (Emergency Use Authorization) สำหรับการนำพลาสมาจากผู้ป่วยโรคโควิด-19 ที่ฟื้นตัวแล้ว เพื่อนำมารักษาผู้ป่วยโควิด-19 โดยระบุสาเหตุการพิจารณาอนุญาตว่าคำนึงถึงประโยชน์จากการนำพลาสมาดังกล่าวมาใช้ มากกว่าความเสี่ยงจากผลข้างเคียงที่อาจเกิดขึ้น
การใช้พลาสมาดังกล่าว คือการนำเลือดจากผู้ป่วยโควิด-19 ที่ฟื้นตัวแล้ว มาใช้ประโยชน์ เนื่องจากเลือดของผู้ที่ฟื้นตัวจากโควิด-19 จะมีการสร้างสารภูมิต้านทานขึ้น ขณะที่พลาสมาที่ถูกนำมาใช้งาน จะเป็นพลาสมาจากเลือดที่มีโปรตีนภูมิคุ้มกัน (Convalescent Plasma)
ขณะที่ FDA ระบุว่า ปัจจุบันมีผู้ป่วยโควิด-19 ในสหรัฐฯ มากกว่า 70,000 คน ที่อยู่ระหว่างการรักษาด้วยพลาสมาดังกล่าว
“วันนี้ ผมยินดีมากกับคำประกาศครั้งประวัติศาสตร์อย่างแท้จริงในสงครามการต่อสู้กับไวรัสจีน ซึ่งจะช่วยชีวิตคนได้นับไม่ถ้วน การดำเนินการในวันนี้จะเพิ่มการเข้าถึงการรักษาด้วยวิธีนี้ได้อย่างมาก” ประธานาธิบดีโดนัลด์ ทรัมป์ กล่าวระหว่างการแถลงที่ทำเนียบขาว
ช่วงสัปดาห์ที่ผ่านมา ทรัมป์กล่าวหาเจ้าหน้าที่สาธารณสุขบางราย ว่าเล่นการเมืองในเรื่องการอนุมัติฉุกเฉินสำหรับการใช้พลาสมารักษาผู้ป่วยโควิด-19 หลังจากที่ถูกถามถึงสาเหตุที่ FDA ยังไม่อนุมัติการใช้พลาสมา
ขณะที่หนังสือพิมพ์ The New York Times รายงานเมื่อสัปดาห์ที่ผ่านมา ว่าการอนุมัติใช้งานพลาสมาในกรณีฉุกเฉินของ FDA ถูกระงับหลังการแทรกแซงของกลุ่มเจ้าหน้าที่ระดับสูงในสถาบันสุขภาพแห่งชาติ (NIH) ซึ่งรวมทั้งด็อกเตอร์ฟรานซิส คอลลินส์ ผู้อำนวยการ NIH และด็อกเตอร์แอนโทนี เฟาชี ผู้อำนวยการสถาบันโรคภูมิแพ้และโรคติดเชื้อแห่งชาติ และที่ปรึกษาในคณะทำงานรับมือโควิด-19 ของรัฐบาลทรัมป์ ที่ออกมาโต้แย้งว่าข้อมูลการศึกษาของ FDA เรื่องการใช้พลาสมารักษาผู้ป่วยโควิด-19 นั้นยังอ่อนเกินไปและไม่น่าเชื่อถือ
การแทรกแซงดังกล่าวทำให้ด็อกเตอร์อนันต์ ชาห์ รองคณะกรรมาธิการฝ่ายกิจการทางการแพทย์และวิทยาศาสตร์ของ FDA โต้แย้งว่า NIH นั้นกำลังล้ำเส้น และไม่มีส่วนเกี่ยวข้องใดๆ ต่อการตัดสินใจของ FDA อีกทั้่งยังไม่มีข้อมูลลับทั้งหมดที่ FDA ใช้เพื่อพิจารณาอนุมัติการใช้งานพลาสมาในกรณีฉุกเฉินด้วย
“เราให้ความสำคัญอย่างจริงจังในการปฏิบัติตามข้อมูลและวิทยาศาสตร์ เกี่ยวกับการตรวจสอบผลิตภัณฑ์ทางการแพทย์เพื่อป้องกันหรือรักษาผู้ป่วยโควิด-19 ตามมาตรฐานทางกฎหมายและกฎข้อบังคับที่กำหนดขึ้นของ FDA” ชาห์ ระบุ
ทั้งนี้ ตั้งแต่ช่วงปลายเดือนมีนาคมที่ผ่านมา FDA ได้กำหนดแนวทางสำหรับนักวิทยาศาสตร์ ในการทดลองนำพลาสมาจากผู้ป่วยโควิด-19 ที่ฟื้นตัวแล้ว มาใช้รักษาผู้ป่วยโควิด-19 ตามโรงพยาบาลต่างๆ เพื่อศึกษาถึงประสิทธิภาพและผลกระทบจากการใช้พลาสมาที่อาจเกิดขึ้น โดยมีผู้ป่วยโควิด-19 ที่ได้รับการทดลองรักษาด้วยพลาสมาแล้วกว่า 60,000 คน
อย่างไรก็ตาม พลาสมาจากผู้ป่วยโควิด-19 ที่ฟื้นตัวนั้นมีจำกัด และต้องมาจากการบริจาคเลือดโดยความยินยอมของผู้ป่วย ซึ่งแม้ในการศึกษาทดลองจะพบสัญญาณที่ดีในประสิทธิภาพของพลาสมา แต่ก็ยังไม่มีการสุ่มทดลองใช้รักษาผู้ป่วย
ขณะที่เจ้าหน้าที่ระดับสูงของรัฐบาลรายหนึ่งเปิดเผยต่อสำนักข่าว CNN ว่าการประกาศอนุมัติใช้งานพลาสมากรณีฉุกเฉิน สำหรับผู้ป่วยโควิด-19 นั้นเป็นความก้าวหน้าครั้งสำคัญ โดยมั่นใจในข้อมูลความปลอดภัย ในการใช้พลาสมาทดลองรักษาผู้ป่วยโควิด-19 กว่า 70,000 คน ตลอด 5 เดือนที่ผ่านมา
“หากคุณเป็น 1 ใน 35 คนจาก 100 คน ที่รอดชีวิตจากอาการป่วยด้วยโรคโควิด-19 ขั้นรุนแรงได้เพราะใช้พลาสมา นี่เป็นความก้าวหน้าอย่างแน่นอน” เจ้าหน้าที่รายดังกล่าวระบุ
พิสูจน์อักษร: ลักษณ์นารา พักตร์เพียงจันทร์
อ้างอิง: